IONIZACIÓN DEL AGUA.
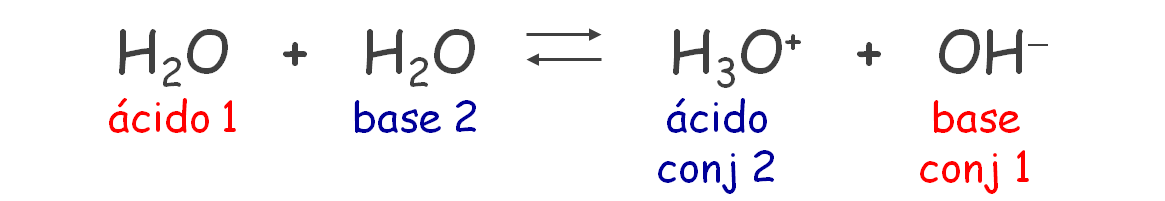
El agua es un compuesto covalente polar formado por moléculas, sin embargo se lo considera como un electrolito débil debido a que tiene la capacidad de autoionizarse ligeramente en iones de hidronio e iones hidroxilo.
El agua puede actuar como un ácido cuando dona un protón y también como una base ya que recibe un protón. Este comportamiento es característico de las sustancias anfipróticas.
* Los corchetes representan la concentración de moles por litro.
Al ser el producto iónico del agua una constante, cuando ocurren adiciones de ácidos o bases ocurre una reacción de equilibrio que compensa las concentraciones con el fin de mantener el valor inalterado.
-Si se añaden iones hidronio debido a las adiciones de ácido, estos reaccionan con los iones hidroxilo disminuyendo su concentración:
*Si aumenta la concentración de iones hidronio, disminuye la concentración de hidroxilo.
*Si aumenta la concentración de iones hidroxilo, disminuye la concentración de hidronio.
PARA RESUMIR:
* Tenemos una solución ácida cuando:
[H3O+]
> [OH-] ; [H3O+]
> 1x 10-7 M
* Tenemos una solución neutra cuando:
[H3O+]
= [OH-]
* Tenemos una solución básica cuando:
[H3O+]
< [OH-].
EJEMPLOS:
---> El jugo de limón tiene na concentración de iones hidronio a 0.01M. ¿Cuál es la concentración de iones hidroxilo?
[H3O]+
. [OH] = 1x10-14
[0.01]
. [OH]
= 1x10-14
[OH] = 1x10-14 / 0.01
[OH] = 1x10-12
---> Una solución limpiadora fabricada a partir del amoníaco tiene una concentración de iones hidroxilo de 1x10-3 , calcula la concentración de iones hidronio.
[H3O]+
. [OH] = 1x10-14
[H3O]+
. [1x10-3] = 1x10-14
[H3O] = 1x10-14/ 1x10-3
[H3O] = 1x10-11
No hay comentarios:
Publicar un comentario