DIFERENCIAS ENTE UN ACIDO Y UNA BASE
Según Arrhenius.
Ácido Según Arrhenius.
|
Bases según Arrhenius.
|
Producen iones hidrogeno (H-) en soluciones
acuosa.
|
Producen iones hidroxilo (OH-) en solución
acuosa.
|
Tiene sabor agrio.
|
Tiene sabor amargo.
|
El papel tornasol toma color rojo al contacto con
ellos.
|
El papel tornasol toma color azul al contacto con
ellos.
|
Cuando un ácido y una base se
juntan forman una sal y agua, esta reacción se conoce como neutralización. Por
ejemplo:
El tornasol es una sustancia que
se extrae de un liquen, el cual sirve como indicador cualitativo de pH.
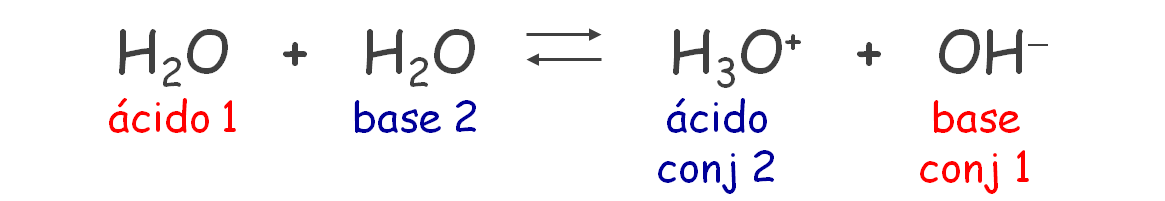
Ácidos bases según Bronsted y Lowry.
Un ácido es una sustancia
donadora de protones, y una base es una sustancia receptora de protones.
El agua es una sustancia anfiprótica.
Anfiprótica à
Son aquellas que pueden actuar como un
ácido o como una base.
Esto da origen a que un ácido genere una base, la
cual es el ácido sin un protón, y de la misma forma que la base al recibir un
protón genere una sustancia que tendrá la capacidad de donar un protón actuando
como acido. Esas parejas se denominan pares
conjugados acido-base. Por ejemplo:
Los ácidos al donar protones se
quedan con iones negativos y las bases, al recibir protones, se quedan con
iones positivos.
Ácidos y bases según Lewis.
Según Lewis, un ácido es una
sustancia capaz de aceptar y compartir un par de electrones; en tanto que una
base es aquella que dona y comparte un par de electrones. Ejemplo:
TIPOS DE ÁCIDOS
Dependiendo de la cantidad de iones
hidronio que un ácido puede donar, los ácidos pueden ser monopróticos,
dipróticos, o polipróticos.
Los ácidos orgánicos se
caracterizan por la presencia del grupo carboxilo –COOH en su fórmula y el
protón que son capaces de ceder es aquel que está unido a un átomo de oxígeno.
Ácidos y bases, fuertes y débiles.
La capacidad de ionizarse de los
ácidos como de las bases es la responsable de que estas sustancias sean
catalogadas como fuertes o débiles. Los ácidos se separan en hidrógenos y
radicales.
Ionización à Capacidad de
separarse.
Los ácidos fuertes son aquellos
que se ionizan casi totalmente en agua, esto quiere decir que donan todos sus
protones.

Los ácidos débiles son aquellos
que se ionizan parcialmente o en muy poca proporción. La mayoría de ácidos
inorgánicos y todos los ácidos orgánicos son débiles.

LAS BASES FUERTES
TAMBIÉN SE CONOCEN COMO ÁLCALIS O HIDRÓXIDOS Y SON PELIGROSAS YA QUE
DESTRUYEN LOS TEJIDOS Y PROVOCAN QUEMADURAS QUÍMICAS.
|
Las
bases fuertes son aquellas que se ionizan casi totalmente en agua, se ionizan
de forma parcial, produciendo iones oxidrilo. Todos los oxidrilos que se forman
con los metales del grupo 1 y los oxidrilo de calcio, estroncio y bario son
fuertes. Las bases fuertes son:
Li(OH) NH4(pH)
Na(OH) Ca(OH)
K(OH) Sr(OH)
Cs(OH) Ba(OH)
Rb(OH)
Fr (OH)
Ag (OH)
El oxidrilo de sodio es la Base
más fuerte conocida. El hidróxido de magnesio es una base débil, es poco
soluble en agua y se usa como principio activo de los medicamentos antiácidos
conocido como leche de magnesia.
Debido a su escasa ionización es muy seguro ingerirlo.
REACCIONES DE LOS ÁCIDOS.
Reacción con metales que se encuentren sobre el hidrógeno.
Reaccionan con ácidos
desprendiendo gas hidrógeno y formando una sal. Utilizando en procesos de
obtención y tratamiento de metales.

Reacción con carbonatos y bicarbonatos.
Reaccionan con los carbonatos y
bicarbonatos desprendiendo CO2 gaseoso.

REACCIÓN DE NEUTRALIZACIÓN
Ocurre cuando se combinan ácidos y bases entre sí.
Esta reacción se conoce como neutralización y los productos
que forman son una sal y agua. Ejemplo:

Etalpia à
Cantidad de calor que contiene un cuerpo o una reacción.
LAS SALES SON EL COMPONENTE FUNDAMENTAL DE MUCHOS
MINERALES QUE SE ENCUENTRAN EN LA CORTEZA TERRESTRE.
|
PROPIEDADES DE LAS SALES.
Las sales son por lo general compuestos
sólidos, compuestos por enlaces iónicos, forman cristales y muchos se
solubilizan en agua constituyendo iones.
Tienen alto punto de fusión, baja
dureza y son poco comprensibles. Su sabor es salado, disueltos en agua fundidas
conducen a la corriente eléctrica.
ELECTROLITOS Y NO ELECTROLITOS
Toda sustancia o soluto que
disuelto en agua libera iones dando origen a una solución capaz de conducir la
corriente eléctrica, se conoce como electrolito.
Los compuestos iónicos cuando
están disueltos o fundidos son electrolitos. Los compuestos ionices no se
disuelven en solventes no polares como aceite, gasolina o tetracloruro de
carbono. El agua por sí sola no se
considera un electrolito, debido a que es un mal conductor de la electricidad.
Las sustancias formadas por
enlaces covalentes no conducen la electricidad ni disueltos, ni fundidos, por
lo que se le conoce como
no
electrolitos.
Se clasifican en electrolito
fuerte o débil de acuerdo al grado de ionización de las sustancias disueltas en
agua.
Cuando tiene OH es base, cuando
tiene H es acido, y cuando no tiene ninguno de estos es una sal.
CONDUCTIVIDAD
La conductividad es la medida de
la capacidad que tiene una sustancia para dejar pasar la corriente eléctrica y
está relacionada con la cantidad de sales presentes en la solución.
A mayor cantidad de sales
presentes en la ionización mayor es la conductividad.
La conductividad tiene cuatro
parámetros que se deben tomar en cuenta las cuales son:
1. Estructura
Atómica.
2. Propiedades
Físicas.
3. Temperatura.
CONCENTRACIONES FÍSICAS.
Cuando se expresa la
concentración de una solución en porcentaje y no se especifica el tipo, se
refiere a m/v.
Concentración porcentaje peso a peso % p/p.
Es la masa del soluto expresado
en 100 gr. De solución por 100.
% p/p = m. soluto x 100
M. soluto + M.
solvente
Ejemplo:
Calcular el porcentaje, peso a peso de una solución que contiene 35gr
de hidróxido de plata (Ag (OH)), en 110 gr. De solvente
% p/p = 35gr = 24.14 % p/p Ag (OH).
35gr+110gr
Concentración porcentaje peso volumen
% p/v.
La fórmula de esta concentración seria:
% p/v = m. soluto gr x 100
V. solución ml
Ejemplo:
Calcular el porcentaje p/v de una solución de 120 ml de hidróxido de
sodio que contiene 20gr. De este hidróxido.
% p/v = 20gr x 100 =
16.67 % p/v Na (OH)
120ml
Concentración porcentaje volumen
volumen % v/v.
La fórmula de esta concentración será:
% v/v = m. soluto ml x 100
v. solución ml
Ejemplo:
Calcular el porcentaje v/v de una solución de ácido sulfúrico que
contiene 15ml de este acido en 130ml de agua destilado.
% v/v = 15gr x 100 =
10, 34 % v/v H2SO4
145ml
Partes por millón
La fórmula de esta concentración será:
p.p.m = mgr soluto
Kgr solución
Ejemplo:
Calcular las p.p.m de una solución que contiene cloruro de sodio en
cantidad de 15gr en una masa de solución de 300gr.
M soluto= 15gr. à 15000 mgr.
M solución= 300gr à0.3 kg
Ppm= 15000mgr. =
50000 p.p.m NaCl
0, 3
MOLARIDAD.
Es la unidad más utilizada para expresar concentración de las
soluciones.
Molaridad= moles de soluto
Litro de
solución
Ejemplo:
Calcular la molaridad de una solución que contiene 25gr. De Hidróxido
de sodio disueltos en 1.5 lt. De solución.
M= ms gr. = M=
25gr
PM (gr/mol)
40gr/mol = 0.42 moles.
V solución (pts.) 1.5 lts.
Na (OH)
Na= 23x1=23
O= 16x1= 16
H= 1x1 = 1
40 gr/mol.
NORMALIDAD.
Numero de equivales gr. Del soluto para el volumen de la solución.
N= Número de equiv.-gr soluto
à N=
M soluto (gr)
Volumen solución (lt) # equiv gr =
V solución (lt)
Como sacar el equivalente gramo en:
Ácido à Equiv gr.
PM ácido
# #
Base à Equiv gr.
PM base
# (OH)
Sal à Equiv gr.
PM sal
Valencia metal
Ejemplo:
Calcular la normalidad del ácido nítrico cuya masa es de 50gr. Es un
volumen de solución de 1.2 Hr.
HNO3
H= 1x1=1 N=
50gr. = 0.66
N=14x1=14 63 equiv-gr.
O=16x3=48 1.2 lt.
63gr/mol.
N= 0.66 normal.
Equiv
gr. 63
1
= 63.